Imaginez le plaisir de la découverte lorsque plus de 10 années de recherche sur l’origine d’une maladie génétique commune, la fibrose kystique (FK), ont permis de retrouver l’origine d’un groupe d’Européens distincts mais mystérieux qui vivaient il ya environ 5 000 ans.
La FK est la maladie héréditaire la plus répandue, potentiellement mortelle, chez les Caucasiens - environ un sur 40 est porteur de la mutation dite F508del. Généralement, seules les mutations bénéfiques, qui offrent un avantage de survie, se propagent largement dans une population.
La mucoviscidose entrave la libération des enzymes digestives du pancréas, ce qui déclenche la malnutrition, provoque une maladie pulmonaire finalement fatale et produit une concentration élevée de sel dans la sueur, pouvant mettre la vie en danger.
Ces dernières années, les scientifiques ont révélé de nombreux aspects de cette maladie pulmonaire mortelle qui ont conduit à un diagnostic précoce systématique chez les bébés soumis à un dépistage, à de meilleurs traitements et à une vie plus longue. D'autre part, la communauté scientifique n'a pas été en mesure de savoir quand, où et pourquoi la mutation est devenue si courante. En collaborant avec une équipe extraordinaire de scientifiques européens tels que David Barton en Irlande et Milan Macek en République tchèque, en particulier avec un groupe de généticiens brillants à Brest, en France, dirigés par Emmanuelle Génin et Claude Férec, nous pensons savoir où et quand. la mutation originale est née et dans laquelle l'ancienne tribu de personnes.
Nous partageons ces résultats dans un article paru dans le European Journal of Human Genetics, qui représente l'aboutissement de 20 années de travail impliquant neuf pays.
Qu'est-ce que la fibrose kystique?
Ma quête pour déterminer comment la FK est apparue et pourquoi elle est si courante a commencé peu après que les scientifiques aient découvert le gène CFTR causant la maladie en 1989. La mutation la plus courante de ce gène qui cause la maladie s'appelait F508del. La maladie mortelle a été causée par deux copies de la mutation, l’une héritée de la mère et l’autre du père. Cependant, hériter d'une seule copie ne causait aucun symptôme et faisait de la personne un «porteur».
Je travaillais à l’Université du Wisconsin depuis 1977 en tant que médecin-scientifique spécialisé dans le diagnostic précoce de la mucoviscidose par le biais du dépistage néonatal. Avant la découverte du gène, nous avions identifié les bébés à risque élevé de FK en utilisant un test sanguin qui mesurait les niveaux de protéine appelée trypsinogène immunoréactif (TRI). Des taux élevés de TIR suggèrent que le bébé était atteint de FK. Lorsque j’ai appris la découverte d’un gène, j’étais convaincu que cela changerait la donne à la fois en matière de développement de tests de dépistage et de recherche épidémiologique.
En effet, avec le gène, nous pourrions proposer aux parents un test plus informatif. Nous pourrions leur dire non seulement si leur enfant était atteint de mucoviscidose, mais également s'ils portaient deux copies d'une mutation de CFTR, qui causait la maladie, ou seulement une copie qui en faisait un porteur.
On pourrait se demander quel est le lien entre l’étude du dépistage néonatal de la FK et l’apprentissage de l’origine de la maladie. La réponse réside dans la façon dont notre équipe de recherche au Wisconsin a transformé un test de dépistage biochimique utilisant le marqueur IRT en une méthode à deux niveaux appelée IRT / ADN.
Étant donné qu'environ 90% des patients atteints de FK aux États-Unis et en Europe ont au moins une mutation F508del, nous avons commencé à analyser la présence de sang nouveau-né chaque fois que le niveau de TIR était élevé. Mais lorsque ce dépistage IRT / ADN en deux étapes est effectué, non seulement les patients atteints de la maladie sont diagnostiqués, mais également dix fois plus de nourrissons porteurs de la maladie.
Comme le dépistage prénatal, prénatal et néonatal de la mucoviscidose a proliféré au cours des deux dernières décennies, les milliers de personnes qui ont découvert qu’elles étaient porteuses du virus F508del et leurs parents concernés ont souvent posé des questions sur l’origine et l’importance de la porteuse de cette mutation. les enfants. Souffriraient-ils avec un exemplaire? Y avait-il un avantage pour la santé? Il est frustrant pour un pédiatre spécialisé dans la mucoviscidose de ne pas avoir de réponse à leur donner.
Le défi de trouver l'origine de la mutation CF
Je voulais me concentrer sur l'apparition de cette mutation génétique. Repérer cette période nous permettrait de comprendre comment elle aurait pu évoluer pour procurer un avantage, du moins au début, aux personnes qui en bénéficiaient en Europe. Pour étendre mes recherches, j'ai décidé de prendre un congé sabbatique et de suivre une formation en épidémiologie, tout en suivant des cours en 1993 à la London School of Hygiene and Tropical Medicine.
Le moment était bien choisi car le domaine de la recherche sur l'ADN ancien commençait à s'épanouir. De nouvelles techniques révolutionnaires telles que la réaction en chaîne de la polymérase ont permis d’étudier l’ADN de momies et d’autres spécimens archéologiques humains provenant de sépultures préhistoriques. Par exemple, les premières études ont été effectuées sur l'ADN de l'homme tyrolien Iceman âgé de 5 000 ans, qui est devenu plus tard connu sous le nom d'Ötzi.
J'ai décidé que nous pourrions peut-être découvrir l'origine de la mucoviscidose en analysant l'ADN des dents de personnes de l'âge de fer enterrées entre 700 et 100 av. J.-C. dans des cimetières de toute l'Europe.
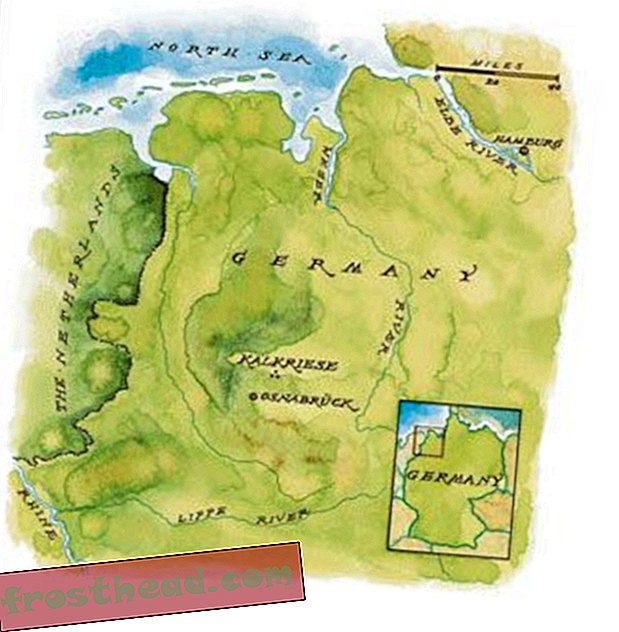
À l'aide de cette stratégie, j'ai collaboré avec des archéologues et des anthropologues tels que Maria Teschler-Nicola au Natural History Museum de Vienne, qui ont donné accès à 32 squelettes ensevelis vers 350 av. Les généticiens en France ont recueilli l'ADN des anciennes molaires et l'ont analysé. À notre grande surprise, nous avons découvert la présence de la mutation F508del dans l'ADN de trois squelettes sur 32.
Cette découverte de F508del dans des sépultures datant du radiocarbone datant de 350 ans av. Mais obtenir des spécimens de l'âge du bronze et du néolithique pour de telles études directes s'est avéré difficile, car moins de sépultures sont disponibles, les squelettes ne sont pas aussi bien préservés et chaque cimetière représente simplement une tribu ou un village. Ainsi, plutôt que de dépendre d'ADN ancien, nous avons modifié notre stratégie pour examiner les gènes de l'homme moderne afin de déterminer le moment où cette mutation s'est produite.
Pourquoi une mutation nuisible se répandrait-elle?
Pour trouver l'origine de la mucoviscidose chez des patients modernes, nous savions que nous devions en savoir plus sur la mutation de signature - F508del - chez les personnes porteuses ou atteintes de la maladie.
Cette minuscule mutation entraîne la perte d'un acide aminé de la chaîne des 1 480 acides aminés et modifie la forme d'une protéine à la surface de la cellule qui déplace le chlorure dans et hors de la cellule. Lorsque cette protéine est mutée, les personnes portant deux copies de celle-ci - l'une de la mère et l'autre du père - sont envahies par un mucus épais et collant dans les poumons, le pancréas et d'autres organes. Le mucus dans leurs poumons permet aux bactéries de se développer, détruisant les tissus et entraînant éventuellement une défaillance des poumons. Dans le pancréas, les sécrétions épaisses empêchent la glande de fournir les enzymes dont le corps a besoin pour digérer les aliments.
Alors, pourquoi une telle mutation nuisible continuerait-elle à se transmettre de génération en génération?
Une mutation aussi néfaste que F508del n'aurait jamais survécu chez les personnes possédant deux copies du gène CFTR muté, car elles sont probablement décédées peu de temps après la naissance. Par ailleurs, les personnes portant une mutation peuvent avoir un avantage en termes de survie, comme le prédit la théorie de Darwin sur la «survie du plus apte».
Le meilleur exemple de mutation favorisant la survie dans des conditions environnementales difficiles peut être trouvé en Afrique, où le paludisme mortel est endémique depuis des siècles. Le parasite responsable du paludisme infecte les globules rouges dont le constituant principal est l’hémoglobine, une protéine qui transporte l’oxygène. Les personnes porteuses du gène normal de l'hémoglobine sont vulnérables à cette maladie transmise par les moustiques. Mais ceux qui sont porteurs du gène «hémoglobine S» muté, avec un seul exemplaire, sont protégés du paludisme grave. Cependant, deux copies du gène de l'hémoglobine S provoquent la drépanocytose, qui peut être fatale.
Ici, il y a un net avantage à porter un gène mutant: en fait, environ un Africain sur dix porte un seul exemplaire. Ainsi, pendant de nombreux siècles, un facteur environnemental a favorisé la survie des individus porteurs d’un seul exemplaire de la mutation de l’hémoglobine faucille.
De même, nous nous sommes demandé s'il était avantageux pour la santé de porter un seul exemplaire de cette mutation spécifique de la FK lors d'expositions à des conditions environnementales stressantes. C’est peut-être pour cette raison que la mutation F508del était courante chez les Européens du Caucase et les populations dérivées de l’Europe.
Indices de l'ADN moderne
Pour comprendre l'avantage de la transmission d'un seul gène F508del muté de génération en génération, nous avons d'abord dû déterminer quand et où la mutation s'est produite de manière à pouvoir découvrir le bénéfice que cette mutation confère.
Nous avons obtenu des échantillons d'ADN de 190 patients CF atteints du F508del et de leurs parents résidant dans des populations européennes géographiquement distinctes d'Irlande à la Grèce, plus une population américaine provenant d'Allemagne. Nous avons ensuite identifié une collection de marqueurs génétiques - essentiellement des séquences d'ADN - dans le gène CF. et des emplacements adjacents sur le chromosome. En identifiant la date d'apparition de ces mutations dans les populations étudiées, nous avons pu estimer l'âge du plus récent ancêtre commun.
Ensuite, par des analyses informatiques rigoureuses, nous avons estimé l’âge de la mutation de la FK dans chaque population résidant dans les différents pays.
Nous avons ensuite déterminé que l'âge du plus vieil ancêtre commun était compris entre 4 600 et 4 725 ans et provenait du sud-ouest de l'Europe, probablement dans des colonies situées le long de l'océan Atlantique et peut-être dans la région de France ou du Portugal. Nous pensons que la mutation s'est rapidement propagée en Grande-Bretagne et en Irlande, puis vers des populations d'Europe centrale et du sud-est telles que la Grèce, où le F508del a été introduit il y a seulement 1 000 ans.
Qui a propagé la mutation de la mucoviscidose dans toute l'Europe?
Ainsi, nos données récemment publiées suggèrent que la mutation F508del est apparue au début de l'âge du bronze et s'est propagée de l'ouest vers le sud-est de l'Europe au cours d'anciennes migrations.
De plus, prenant en compte les archives archéologiques, nos résultats nous permettent d’introduire un nouveau concept en suggérant qu’une population connue sous le nom de Bell Beaker était probablement la population migrante responsable de la dissémination précoce de F508del dans l’Europe préhistorique. Ils sont apparus à la transition du néolithique tardif, vers 4000 av. J.-C., au début de l'âge du bronze, au troisième millénaire av. J.-C., quelque part en Europe occidentale. Ils se distinguent par leurs béchers en céramique, leurs pionniers dans la métallurgie du cuivre et du bronze au nord des Alpes et leur grande mobilité. En fait, toutes les études montrent qu’ils étaient très migrés et qu’ils voyageaient dans toute l’Europe occidentale.
Pendant environ 1 000 ans, un réseau de petites familles et / ou de tribus d'élite a étendu sa culture d'ouest en est dans des régions qui correspondent de près à l'Union européenne actuelle, où l'incidence de la FK est la plus élevée. Leurs migrations sont liées à l’avènement de la métallurgie en Europe occidentale et centrale, dans la mesure où ils fabriquaient et commercialisaient des produits métalliques, en particulier des armes, tout en voyageant sur de longues distances. Il est également supposé que leurs voyages ont été motivés par l'établissement de réseaux de mariage. Le plus pertinent pour notre étude est la preuve qu'ils ont migré dans une direction et sur une période de temps qui correspond bien à nos résultats. Des données génomiques récentes suggèrent que la migration et la transmission culturelle ont joué un rôle majeur dans la diffusion du «complexe de Beaker» et ont conduit à une «transformation démographique profonde» en Grande-Bretagne et ailleurs après 2400 av.
Déterminer quand F508del a été introduit pour la première fois en Europe et découvrir son origine devrait permettre de mieux comprendre la forte prévalence de porteurs - et de déterminer si la mutation confère un avantage évolutif. Par exemple, les Européens de l'âge du bronze, bien que migrant beaucoup, ont apparemment été épargnés par l'exposition à des maladies infectieuses endémiques ou à des épidémies; ainsi, la protection contre une maladie infectieuse, comme dans la mutation de la drépanocytose, par le biais de cette mutation génétique semble improbable.
Grâce aux recherches archéologiques et génomiques sur les populations de l'âge du bronze et leurs pratiques au cours des migrations, de plus en plus d'indices sur les facteurs environnementaux favorables aux personnes porteuses de cette variante du gène devraient émerger. Ensuite, nous pourrons peut-être répondre aux questions des patients et des parents sur les raisons pour lesquelles ils ont une mutation CFTR dans leur famille et sur les avantages que cela apporte.
Cet article a été publié à l'origine sur The Conversation.
Philip Farrell, professeur de pédiatrie et de sciences de la santé des populations, Université de Wisconsin-Madison